研究内容
癌抑制タンパク質p53の細胞危機ストレス応答メカニズムの解明
癌抑制タンパク質p53は、放射線・紫外線・発癌物質によって引き起こされるDNA損傷などを含む様々な細胞危機ストレスに対して応答し、細胞・組織・個体のゲノム恒常性を守る中心的な役割を果たしています。p53はホモ四量体を形成しており、この四量体形成は癌抑制機能を含むp53機能に必須です。
当研究室では、飢餓ストレスなどの多様な細胞ストレスに対するp53の機能解明を実施しており、これらをとおして新しい癌の治療法開発を目指しています。また、p53進化過程における四量体形成ドメインの安定性変化と転写活性の相関解析、他のファミリーとのヘテロ多量体形成、翻訳後修飾による多量体形成制御機構の解明を実施しています。

脱リン酸化酵素PPMファミリーの機能解明と阻害剤開発
タンパク質のリン酸化・脱リン酸化は、生体内シグナル伝達の制御において最も重要なメカニズムです。脱リン酸化酵素であるストレス応答性PPMファミリーの異常は、癌を含む様々な疾患と関連することが報告されており、特にp53誘導性ホスファターゼPPM1Dの異常は多くの癌で報告されています。当研究室では、強力で特異的な新規PPM1D阻害剤を開発しています。このPPM1D阻害剤はin vitroおよびin vivoで極めて有効に作用することから、PPM1Dを標的とした抗癌剤のリード化合物およびPPM1Dの機能解析における強力な分子ツールとして期待されています。さらに、PPMファミリーの基質認識機構の解明およびPPMファミリーにおける新規な特異的基質同定法の開発および機能調節因子の探索を実施しています。
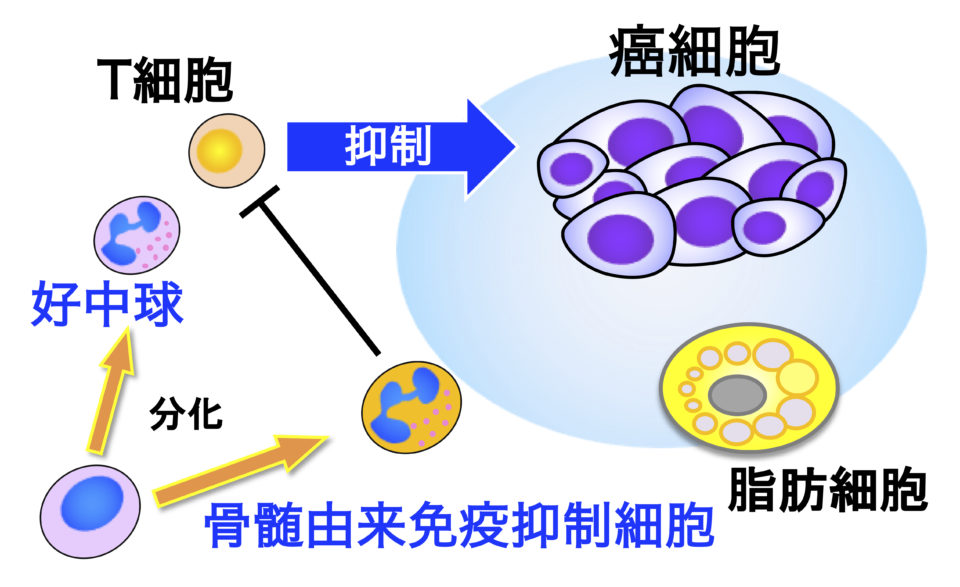
自然免疫細胞によるがん免疫制御機構の解明
生体には、免疫細胞による癌細胞の排除など、細胞の「癌化」を防ぐ様々な機構が存在します。癌の病態においては、骨髄由来免疫抑制細胞(MDSC)が過剰産生され、がん免疫が抑制されていることが知られていますが、MDSC分化を制御する分子および制御機構は不明です。近年、癌の病態で活性化される好中球サブセットである骨髄由来免疫抑制細胞(PMN-MDSC)の腫瘍形成促進が報告され、大きな注目が集まっています。私たちの研究室では、Ser/ThrホスファターゼPPM1Dに注目し、がん免疫療法の障害となるPMN-MDSCや、がん免疫と深く関与する脂肪細胞の分化・免疫抑制能の分子制御機構を明らかにすることを目指しています。
研究室の特徴
「化学反応の集積がなぜ生命となるのか」は、生命科学の最も重要なテーマのひとつです。私たち生物化学研究室は、この解明を究極のゴールとして研究に邁進しています。このため、「化学の視点から生命を理解」を基盤として、癌や免疫など医療にも重要な生命現象を分子レベルでの構造と新規機能とその制御機構の解明を実施しています。これらの研究のために、生化学、分子生物学、細胞生物学、生物物理学、バイオインフォマティクスなど多様な手法を用いています。
生物化学研究室では、学生の研究能力、提案力、プレゼンテーション力を伸ばすためのいろいろなプログラムを用意しています。また、学生が国際性を高めることを推奨しています。