| 研究テーマ | 多量体形成タンパク質の翻訳後修飾・安定性・機能制御機構および進化に関する研究 |
| 研究分野 | ペプチド科学, 生物化学, 進化学 |
| キーワード | ペプチド, タンパク質, 多量体形成, 翻訳後修飾, 癌, 進化 |
研究紹介
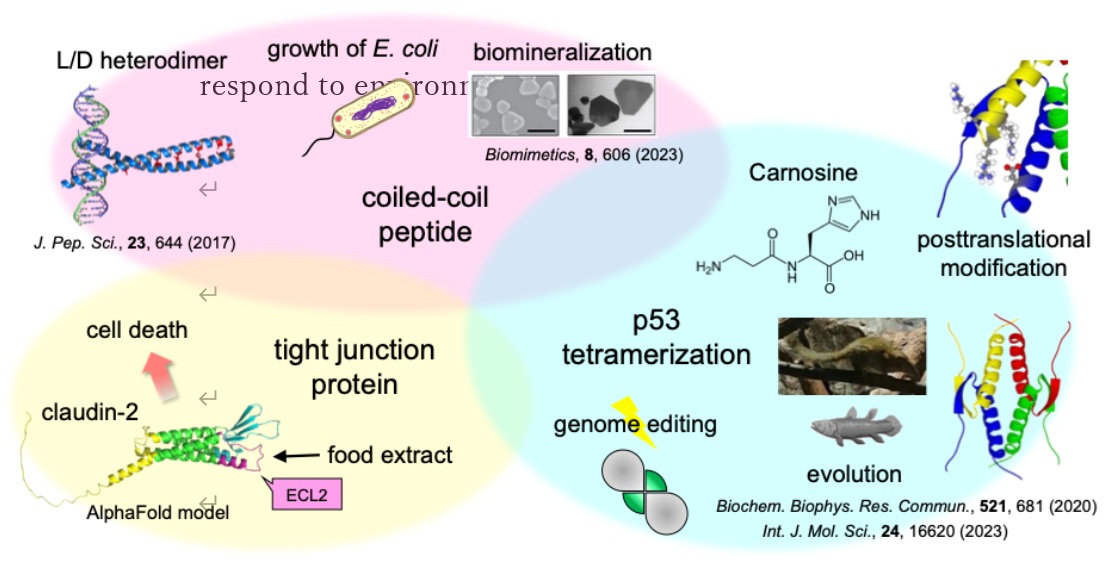
タンパク質多量体化は、生物が獲得した極めて重要なストラテジーです。生物の進化過程においてタンパク質は、多量体形成の調節を介して、より精密な機能制御機構を獲得してきました。癌抑制タンパク質p53は、機能発現に四量体形成ドメインを介したホモ四量体形成が必須です。遺伝毒性ストレスなどの細胞ストレスに応答し、安定化・四量体化・活性化したp53は、細胞周期停止やアポトーシスの誘導により、ゲノムの恒常性を維持しています。p53は、リン酸化やメチル化などのさまざまな翻訳後修飾により機能が制御されています。これまでに、四量体形成ドメインのメチル化修飾による機能調節機構の解明を行いました。ストレス応答に重要なp53は、初期の脊椎動物であるヤツメウナギから発現がみられます。興味深いことに哺乳類のツパイは、ヒトよりも安定なp53四量体形成ドメインを有することを明らかとし、メチオニン残基が構造安定化に大きく寄与することを見出しました。現在まで、脊椎動物におけるp53の構造・安定性および機能制御機構の進化に関する研究を行なっています。
代表的な研究業績
Natsumi Nakagawa, Shuya Sakaguchi, Takao Nomura, Rui Kamada, James G. Omichinski, Kazuyasu Sakaguchi,
Biochem. Biophys. Res. Commun., 2020, 521, 681-686
Rui Kamada, Natsumi Nakagawa, Taiji Oyama, Kazuyasu Sakaguchi,
J. Pept. Sci., 2017, 23, 644-649
| 学位 | 博士(理学)(北海道大学), Ph.D. (Biochemistry)(モントリオール大学) |
| 学歴・職歴 | 2015年 北海道大学理学部化学科 卒業 2017年 北海道大学大学院総合化学院 修士課程修了 2017-2020年 モントリオール大学 ダブル・ディグリー・プログラム 2018-2020年 日本学術振興会特別研究員 2020年 北海道大学大学院総合化学院 博士後期課程修了 2020-2022年 久留米大学医学部化学教室 助教 2022年- 現職 |
| 所属学会 | 日本ペプチド学会, 日本進化学会, 日本生化学会 |
| 居室 | 理学部6号館 6-5-02室 |