ポスト・リチウムイオン電池の実現を目指して
松井 雅樹 教授 MATSUI Masaki/無機化学研究室

私たちの研究グループではリチウムイオン電池に代わる新たな蓄電池の実現を目指して、「新たな酸化・還元反応を起こす物質の探索」をメインに研究しています。
現在研究を行っている全固体電池やマグネシウムイオン電池だけでなく、過去にはリチウム空気電池などの新しい電池系の研究にも取り組んでいましたが、研究をすればするほどリチウムイオン電池の優秀さを実感し、これまで何度も「今のリチウムイオン電池でいいのでは?」と疑問に思うこともありました。そんな時は、ある画像がいつも戒めになっています(図1)。Appleが2015年のキーノートスピーチで12インチMacBookを発表した際の、内部構造を示した画像です。CPUやSSDなどが含まれるロジックボードとトラックパッドのセンサー以外、本体の大部分を占有するのがバッテリーです。
リチウムイオン電池は電圧、容量共に高く、なおかつ劣化も少ないという非常に優れた電池ですが、例えばパソコン内部のセルを1つ減らす事ができるだけで、パソコンの性能は大幅に向上し、かつ軽量化もできます。この画像を見ると、やはり、さらに小型の蓄電池を開発する必要があると改めて思わされます。

2015年3月のイベントでAppleが発表したもの。画像は、https://www.itmedia.co.jp/pcuser/articles/1503/10/news098.htmlより引用。
蓄電池の発展の歴史
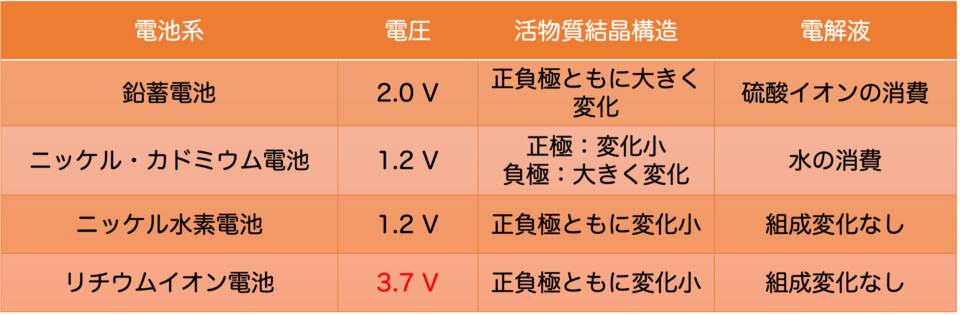
蓄電池はこれまで、活物質の結晶構造や電解液の組成の変化を、小さくするという方向で発展し続けてきました(表1)。
鉛蓄電池
鉛蓄電池は高校の化学の授業では反応式だけを習うと思いますが、活物質の結晶構造を見てみると、正極と負極のいずれも、充電状態と放電状態とで全く異なっていることがわかります(図2)。電極活物質は固体ですので、この結晶構造の変化は固体のままでは起こりません。それでは、なぜこの反応が蓄電池の充放電反応として利用できているのかというと、酸化・還元反応が起こる際に、正極の酸化鉛と負極の鉛からPb2+イオンがわずかに溶け出し、電解液中の硫酸と反応して、すぐに析出するからです(図2)。高校の化学では、「鉛は硫酸に溶けない」と習いますが、ほんの少しだけ溶けるという性質のおかげで、蓄電池の充放電反応として利用できているのです。
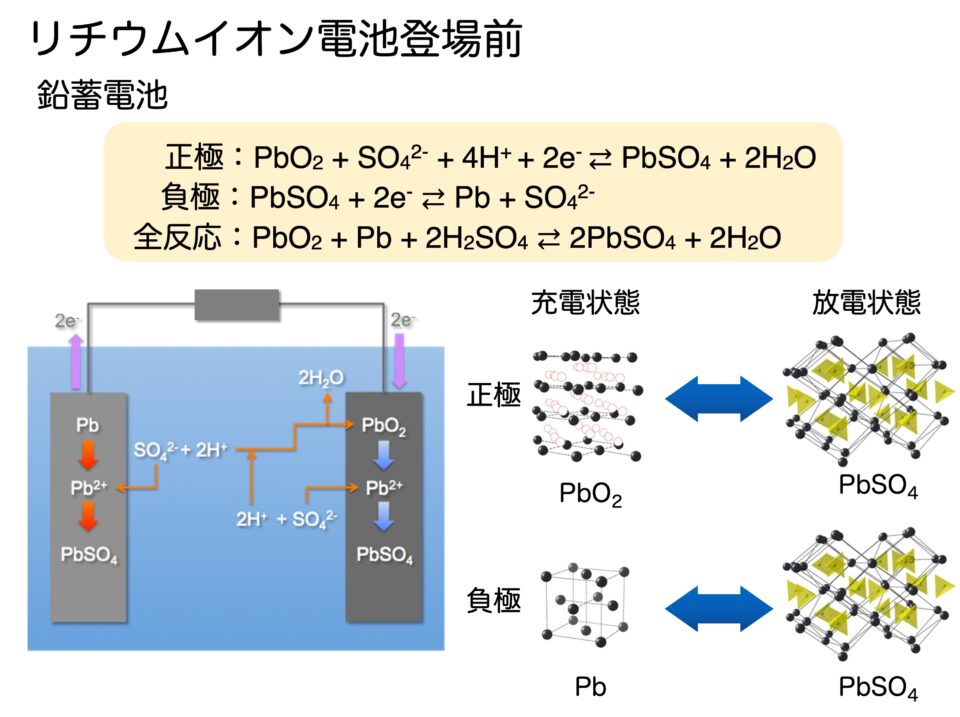
ここで電極の表面が完全に硫酸鉛に覆われてしまうと、硫酸鉛は電気を通さないため充放電ができなくなります。これが「バッテリーが上がった」という状態です。ただし、実際の自動車に使われている鉛蓄電池が長期間使用できるのは、エンジンをかける一瞬だけ放電して、その後はずっと発電機によって充電しているので、放電によって電極の表面が一部硫酸鉛になっても、すぐに充電状態の鉛と酸化鉛に戻されるからです。逆に、冬場に1週間ぐらいエンジンかけずに放置しておくと、この表面が硫酸鉛に変化する反応がジワジワ進むため、バッテリーが上がってしまうのです。
鉛蓄電池はこのように溶解反応が関わるので、自動車のように常に充電状態で使う場合は問題ないのですが、逆にモバイル・デバイスのように充電したエネルギーをフルに利用するデバイスで使用すると、あっという間にバッテリーが上がるということになります。
リチウムイオン電池
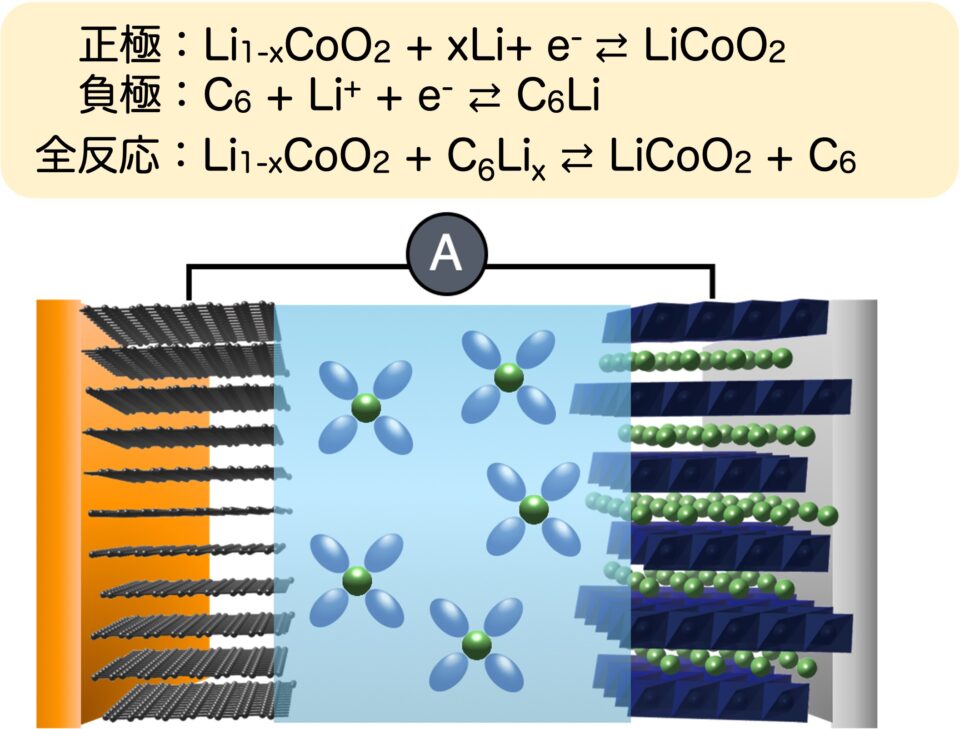
一方、リチウムイオン電池に用いられる電極材料はホスト構造があって、その中のゲストにあたるリチウムイオンが抜けて対極に入るだけ結晶構造の変化はごくわずかですので、充放電反応で電極活物質が完全に元に戻ることができます(図3)。また、充電状態でも、放電状態でも電極活物質は基本的には全く溶けません。
電池を作ったばかりの状態を表す。 完全に元に戻る反応(インターカレーション反応)を利用している。
リチウムイオン電池における充電反応は、左側のグラファイト負極で還元反応によって層間にリチウムが入る一方、右側のLiCoO2正極では酸化反応が起こり、その分のリチウムが抜けていきます。実際にはLiCoO2中の約半分のリチウムしか抜けません。
このホスト構造が電極活物質の体積の大部分を占めるため、容量を増やしづらいのですが、一方、このホストとゲストという構造があるから、完全に元に戻る反応(インターカレーション反応)、99.9%を超える可逆性が実現できるという特徴があります。
また、電池のエネルギーは単純に容量だけではなく容量×電圧で決まるので、他の蓄電池(ニッケル・カドミウム電池、ニッケル水素電池)と比べて約3倍の電圧となる分、多くのエネルギーを貯蔵できるというのが最大の利点です(表1)。
鉛蓄電池やニッケル・カドミウム電池、ニッケル水素電池は電解液が水溶液なので、理論上は1.23Vよりも高い電圧をかけると水が電気分解されます。鉛蓄電池の場合、鉛の上では水は電気分解されにくいので2Vかかっても実用には耐えていますが、これが電圧のほぼ限界です。一方、リチウムイオン電池では有機系電解液を使っているおかげで定格電圧3.7Vを実現しています。リチウムイオン電池をさらに高容量、高電圧化するための研究開発も進められていますが、現行の電極や電解液の組み合わせでは限界が近いと言われており、これがポストリチウムイオン電池の研究開発に注目が集まる主な要因です。
このように、蓄電池の歴史を振り返ると、リチウムイオン電池の原理の延長でエネルギー密度を大幅に向上させるのは、ほぼ不可能であると考えられており、これ以上エネルギー密度を向上するには、過去に淘汰された溶解析出反応のような反応を利用するしか手立てがない、というのが実情です。
研究テーマ
金属の溶解析出反応
現在、私達のグループで検討を続けている研究テーマの1つに、金属の溶解析出反応を蓄電池の反応に利用しようというものがあります(図4)。

これは別に新しいことではありません。2019年ノーベル化学賞を受賞した3人のうちの1人、Stan Whittingham先生がリチウムイオン電池のコンセプトを最初に提唱した時、負極活物質として想定されていたのはリチウム金属でした。しかしながら、後にリチウム金属を用いると充電時に針状に成長して、セルが短絡するために安全な電池を構成するのが難しい事が知られています。最終的には吉野彰先生が提唱したLiCoO2とグラファイトの組み合わせによって安全性が大きく向上し、リチウムイオン電池が誕生しました。
しかしながら、元々に立ち返って、この金属溶解析出反応を利用できれば、ホスト構造によってかさばっていた電極活物質の容量が大幅に増加し、蓄電池のエネルギー密度が高くなることが期待できます。少なくとも負極側はかなりコンパクトになります。
リチウム金属の理論容量を重量当たりと体積当たりでグラファイトと比べると、重量当たりだと1桁、体積当たりだとリチウムは軽いのですが、それでも2.5倍ぐらいになります。2.5分の1の体積で同じ容量が出せることになります。
全固体電池で安全にリチウム金属を使う
私たちはリチウムイオン電池を越える蓄電池の候補として、リチウム金属を負極活物質に用いた、全固体電池の研究を行っています(図5左下)。
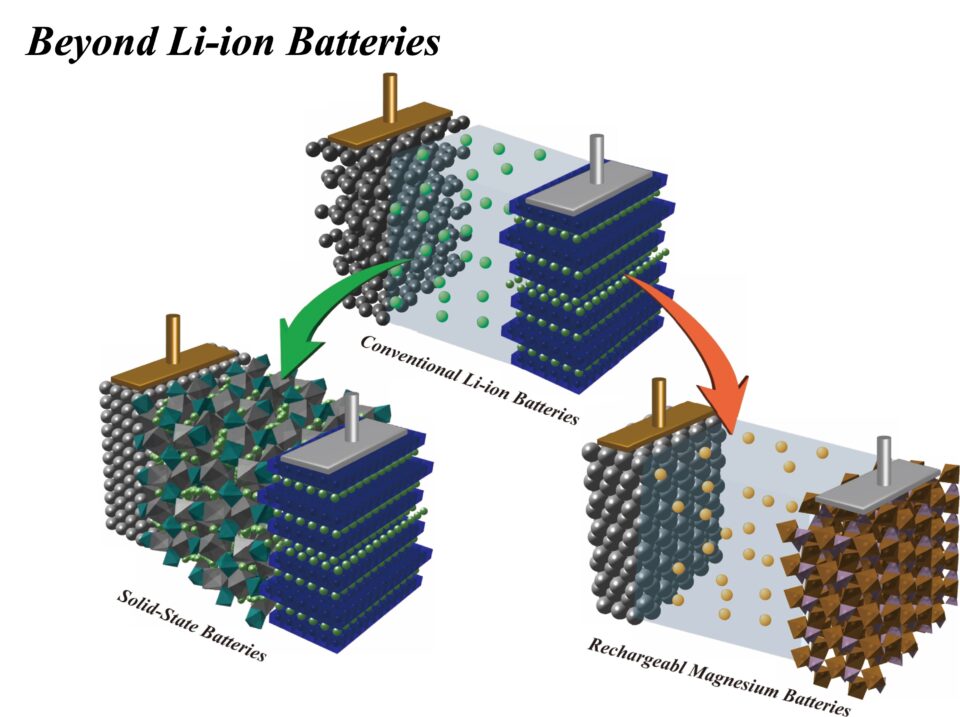
これまでのリチウムイオン電池を越えるものとして、全固体電池(左)とマグネシウム電池(右)を研究している。
これまでのリチウムイオン電池は、有機溶媒にリチウム塩を溶解させたものを電解液として使用していましたが、その電解液を固体のセラミックスに置き換え、リチウム金属が針状成長することがなく、液漏れの心配もない本質的に安全な蓄電池を目指しています。
しかし、固体にするのは簡単ではありません、そもそもリチウムイオンが速く動く固体電解質を見つけることが簡単ではありません。私達は、ガーネット型構造という結晶構造を持ちLi6.4La3Zr1.4Ta0.6O12という複雑な組成の固体電解質を用いて、全固体電池の作製に取り組んでいます(図6)。
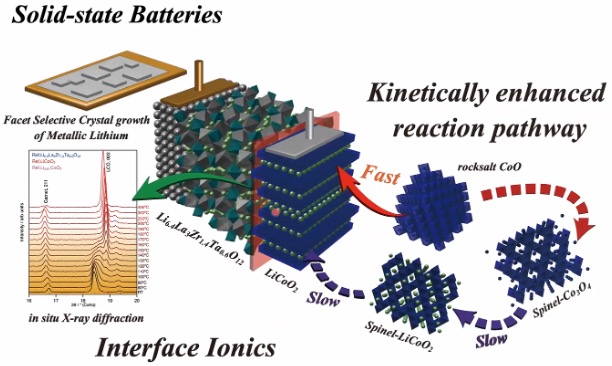
全固体電池を作る際に一番問題となるのが、電解質と活物質(電極の材料となる物質)同士の接合です。これまでのリチウムイオン電池では電解液が液体なので、勝手に染み込み、キレイな界面(境界面)ができます。一方、固体電解質(Li6.4La3Zr1.4Ta0.6O12)と正極(LiCoO2)のようなセラミックス同士の場合、接合させるには熱をかけて焼結しなくてはなりません。
ところが熱をかけると、固体それぞれに含まれる遷移金属、例えばLiCoO2だったらコバルト(Co)、ガーネット型の固体電解質であればジルコニウム(Zr)やタンタル(Ta)、ランタン(La)といった金属イオンが互いに動いてしまい、界面に別の化合物が形成されてしまうのです。熱をかけないと接合できないが、高温にしすぎるとリチウムイオンの通ることのできない層が界面に形成されて、電池として作動しなくなるというジレンマです。
さらに、実際に充電状態の電極との界面の反応を調べてみると、200℃などの意外と低温でも反応が進むことがわかりました。さらに、500℃では固体電解質が完全に分解するということを確認しました。そのため、従来言われていたよりもかなり低温で界面を作るプロセスを考える必要があるということが最近になって分かってきたというのが現状です。
LiCoO2を低温で合成する
何とか低温で界面の形成ができないかと考え、固体電解質をあらかじめ高温で作っておいてから正極を低温で付けるか、正極のシートを高温で作っておいてから固体電解質を低温で合成するかのどちらかに突破口を見出そうとしています。
今メインで取り組んでいるのは、正極のLiCoO2を低温で合成するという研究です。
LiCoO2自体は、市販のリチウムイオン電池に使用されている物質です。通常は、Co3O4を炭酸リチウムなどのリチウム源と混合し、850℃で12時間程度の長時間をかけて焼成することで、粉末を合成しています。この反応では固体の中で複数の元素が原子レベルで混合し、再配列する必要があるので、高温にする必要がありました。
私たちのグループでは、水酸化コバルトを出発原料とすることで、250℃から300℃程度の低温でキレイにLiCoO2を作るプロセスを発見しました(図6右)。この反応機構を調べる過程で、通常は合成温度が低温になると反応速度が遅くなり結晶成長に必要な時間は長くなるはずなのに、この場合、まったく異なる反応メカニズムを取るおかげで30分から1時間もあれば十分に結晶成長することを見出しました。
今はこのプロセスを使った全固体電池の試作に取り組んでいます。さらに、セラミックスの合成プロセスとして200℃や300℃という温度域は非常に低く、これだけ反応時間や反応温度をマイルドにできたので、それを応用して、LiCoO2に限らないさまざまな物質の合成に応用できるプロセスとして研究しています。
これまでの検討で、セラミックスが低温で結晶成長するメカニズムが分かってきたので、周期表にある全ての金属元素のなかで、このプロセスが適用できる元素とそうでない元素の予想ができるようになってきました。今後、蓄電池材料に限らず、省エネルギーのセラミックスの合成プロセスとして体系立てることができたらいいなと考えています。
マグネシウム二次電池の研究
もう1つのテーマとして、同じイオンを使うなら2つの電子を運べるマグネシウムを使う方が、決まったサイズの容器に多くのエネルギーを詰め込むことが可能という考えから、マグネシウム電池の研究にも取り組んでいます(図5右)。
マグネシウムはリチウムと比べると重たいので重量当たりの容量ではリチウムに負けますが、非常に密度が高いので体積当たりになるとリチウムの1.9倍の容量になります。そのため、グラファイト負極と比べると同じ容量を得るのに必要な体積を5分の1にできるということになります。負極をそれだけ小さくするだけでも、実現すれば大きな進歩です。
マグネシウムのメリットは、リチウムで発生した針状(ウィスカー状)の析出が全くできない点にあります。ここに私が2010年にマグネシウム電池の研究を始めたころの最初の論文の図があります(図7)。同じ条件でリチウムとマグネシウムを析出させると、リチウムではウィスカー状に成長するのに対して、マグネシウムではウィスカー状に成長しません。このことをベースに、マグネシウム金属を使った電池の研究に取り組んでいます。

リチウムとは異なり、マグネシウムはウィスカー状に成長しない。
金属の溶解析出を用いた電池では、充放電の過程で電極基板から溶出した金属が、再び戻ってくる必要があります。リチウムイオン電池ではホスト・ゲスト反応なので、ホストによってイオンの戻ってくる場所が指定されています。溶解析出の場合も、同じ場所にいずれかのマグネシウムが戻らなくてはなりません。
そこで、毎回どのような条件でも同じ形に析出してくるようなテクスチャー(材料組織)のコントロールをするようなマグネシウムの析出過程というのを研究しています。EBSD解析(結晶方位解析)によって析出したマグネシウムを断面から見ると(図8左下)、細い針状の析出物が束になっています。実際は板状の析出物の集合体の断面になります。これは、それぞれの粒子の結晶が、ほぼ同じ向きに揃って結晶成長していることを示しています。この場合は六方最密充填でいう最密層のAB面が基板に対して立っている向きに揃っています。
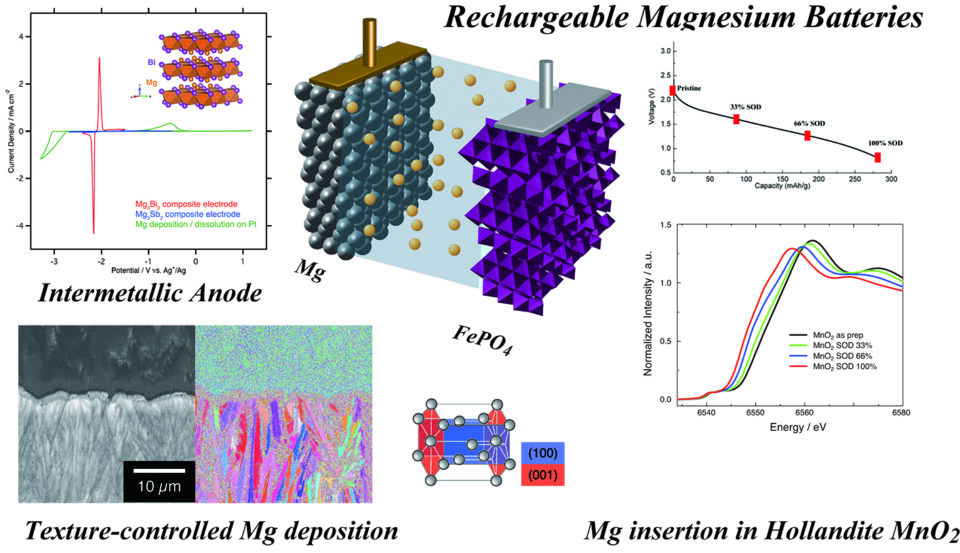
この下地にして、基板側をコントロールすると、どんな電流密度で析出させても、析出するマグネシウムは基板と常に同じ方向を向き、同じような粒子のサイズになって、必ず元の位置に戻ってくるような結晶成長プロセスが実現できそうなところまで来ています。
マグネシウムの挿入脱離可能な新物質探索
一方、正極におけるマグネシウムの挿入脱離反応は、リチウムと異なり非常に困難です。特に酸化物の中では、2価のマグネシウムイオンは酸化物イオンと引きつけ合う力(クーロン相互作用)が強く、1価のリチウムと比較すると、より大きなエネルギー(例えば温度、電場勾配など)が必要になります。そのため、従来はマグネシウムイオンとのクーロン相互作用のやや低い硫化物が、数少ない正極活物質として機能する物質として知られていました。
私達のグループでは、様々な酸化物についてマグネシウムの挿入脱離が起こるかどうかを調べた際に、トンネル構造を持つα-MnO2に可逆にマグネシウムイオンが挿入脱離できることを見出し、報告しています(Electrochem.Commun. 2012)。かなり前の論文で、当時は良い電解液がなかったため、サイクル特性がひどかったのですが、最近は良い電解液が見つかり、近年再注目を集めている物質です。
意外なことに、このマグネシウムの入る酸化物の探索の一つとして、酸化ビスマスの中にマグネシウムが入らないかという実験をやっていたところ、偶然酸化ビスマスがビスマス金属まで還元され、さらにマグネシウムが取り込まれてMg3Bi2という金属間化合物を形成して、マグネシウムの挿入脱離が起こることが分かりました。
これは電池にしても電圧が出せないのですが、本来使いたいマグネシウム金属の代わりの負極にはなります。また、容量が高いことから、マグネシウムイオン電池の負極として可能性があるということで、オリジナルの材料として評価をもらっています。
結局、本質的に難しいのが正極で、これがなかなか見つかりません。「この構造にマグネシウムは入らないか」とか、「この構造の中ではマグネシウムは動かない」などと一生懸命10年やっていますが、まともに動いたのは2つか3つぐらいしかありません。挫けそうになることもありますが、しっかりと動くものも少しずつ見つかってきているので、普通なら固体の中では全く動かないマグネシウムを自由自在に動かせるような、新物質を見出せたらなと思って研究しています。
今後の展望
蓄電池材料の研究開発では、材料の組み合わせや様々な条件によって、想定していた反応以外の反応が起こったりするため、系によっては電極と電解質との界面がどのような様子になっているのか、わかっていないことも少なからずあります。それゆえ、実は科学的に考えるよりは、様々な組み合わせをマンパワーで全部試すことが結局のところ最短ルートとなってしまい、製品を作るという観点では、大学と比べるとやはり企業の方が圧倒的に強いことになります。
先人がとても筋のいい物質を見つけてくれていますが、それが本当にいいものになるかどうかは、その化学反応を見つけられるかどうかにかかっています。私たちは負極に金属を使おうとしていますが、金属の溶解析出反応に加えて、多分もう1つか2つ、何かを見つけなければ、製品にはならないのではないかと思っています。そしてそれは、私たちが見つけなくてはならないようなものなのか、工学的に「えいっ」とやれば済むような話なのか。誰が最後の一番大事な仕事をするのかは、理学とか工学に限らず分からないところだとは思っています。
ボトルネックになっている化学反応、現象が何なのかというところは、組み合わせがあるから非常に複雑です。だから私たち大学にいる人間は、そこを紐解いていくのが役割だと思っています。
Message
企業人から大学の教員になって改めて気づいたのですが、高校の無機化学のカリキュラムは、限られた時間でかなり幅広い範囲をカバーするために、表面をさらうだけの暗記物になってしまっています。最近の教科書は大分良くなってはいるのですが、それでも「これを教えていないのか」とかゆいところに手が届いていないと感じています。
例えば、大学の物理化学では「自由エネルギー」を習うのですが、自由エネルギーをどうして「自由」というのか、聞いたことはありますか? 高校で習うのは反応熱(エンタルピー)で、エンタルピーからエントロピー項を引いた分の残りが自由エネルギーです。これは自発的に進行する反応であれば、理論上自由に利用できるエネルギーで、フラスコの中で起きる普通の化学反応ではだいたい熱として逃げていってしまう分です。電気化学システムは、この自由エネルギーを電気エネルギーとして唯一まともに利用できる系となります。物理化学の教科書には「自由エネルギーは自由に使えるエネルギー」と書かれているのですが、自由エネルギーを実際に使っているシステムというのは、電気化学システム以外に見たことがありません。
また、リチウムイオン電池の中ではコバルトが4価になっていると何気なく言っていますが、コバルトの4価の化合物は一般的な無機材料合成の手法では、ほぼ作ることができません。ところが、皆さんの携帯電話の中では、電池に含まれるコバルトの半分が4価になっているのです。これが高校では習わない電気化学反応のすごいところの1つです。電気化学を学ぶと「雷と同じぐらいの電場の勾配が電極と電解液の界面にかかっている」というミクロな世界の様子について詳しく学ぶことができるのですが、高校だと電気を流して反応式を書いてモル数を計算するところで終わってしまい、なかなか教えてもらえません。
大学では、化学反応ひとつひとつをつかさどる物理現象にまで深堀りをしながら、化学の面白さを学んでもらえると思います。
